人体移植器官严重短缺,那么是不是可以将动物器官移植到人体?
据说,早在 300 多年前,一位名为 Job Janszoon van Meekeren 的阿姆斯特丹外科医生在修补一名士兵的头骨时,就使用了一块狗骨头。这之后,科学家们也在兔子、黑猩猩、猪、老鼠身上做过尝试。
2017 年,被誉为是「基因剪刀手」的哈佛大学和美国 eGenesis 公司异种器官移植课题带头人杨璐菡领衔其团队,克隆出世界首批 PERV 活性灭活猪。当时,其研究成果登上 Science 封面。

时隔 3 年,杨璐菡再次领衔团队,将 CRISPR-Cas9 和转座子技术相结合,做出了有望用于临床的异种器官移植的雏形,实现了异种器官移植的又一重大突破。
异种器官移植:从 1.0 到 3.0
器官移植的概念大家已经不陌生了,但何谓「异种器官移植」?
其实,异种器官移植是指向人体移植非人类器官,这种技术目的在于缓解人体移植器官的短缺问题。
异种器官移植两大难题
由于部分猪体内器官的大小、功能与人类相似,因此科学家们将关注点放在猪器官上面,但潜在的挑战有以下两个。
一方面,猪基因组中携带有猪内源性逆转录病毒(Porcine Endogenous Retroviruses,PERV),这些病毒可能会传播给人类,并可能造成破坏性后果。
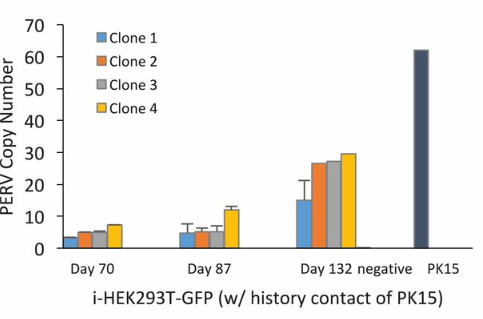
如下图所示,杨璐菡团队对感染 PERV 的细胞 i-HEK293T-GFP 的种群和克隆中的 PERV 拷贝数进行为期长达 4 个多月的观察后,发现 PERV 拷贝数会随时间增加。
如下图所示,杨璐菡团队甚至检测到,即便是没有与猪细胞的接触史,HEK293T 细胞中也有 PERV 元素的存在。
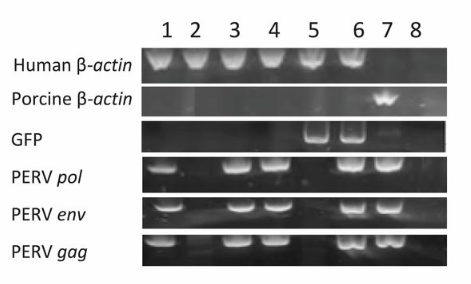
如果说第一张图证明了“猪传人”的可能性,那么第二张图就意味着这种病毒还可以“人传人”。
另一方面,猪移植器官与人体之间会出现免疫和生理分子不相容的情况。
也就是说,要想推进异种器官移植技术的发展,最起码要解决这两大难题。
猪 1.0 解决第一大难题
2017 年 9 月 22 日,杨璐菡团队的论文发表于 Science,宣布解决了第一项难题——猪内源性逆转录病毒(PERV)跨物种传播。

具体来讲,团队使用 CRISPR-Cas9 技术,灭活了猪原代细胞系中的所有 PERV 病毒,又通过体细胞核转移培育出了世界首批 PERV 活性灭活猪,也就是「猪 1.0」。
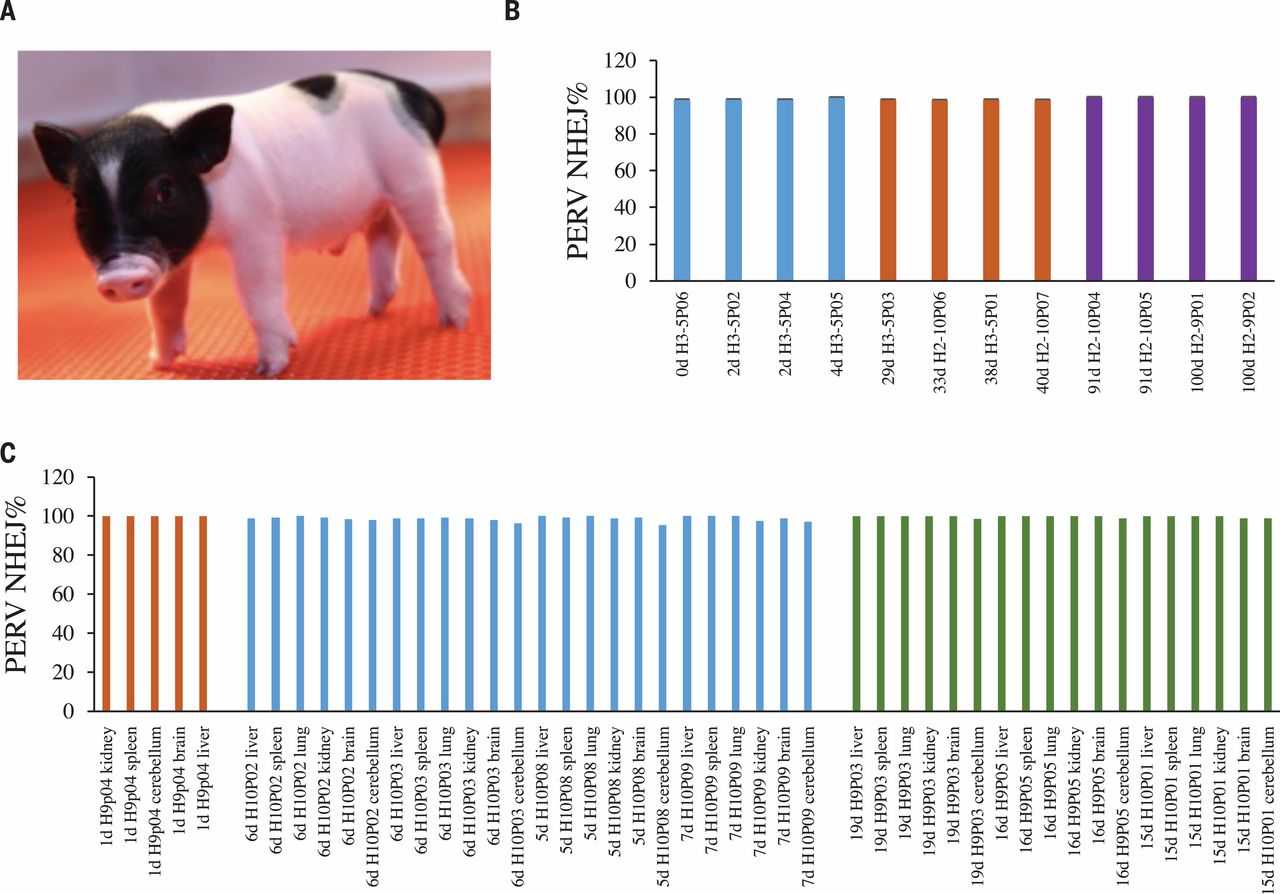
下图 A 部分为出生两天后的 PERV 灭活小猪的照片。
B 部分展示了在基因组 DNA 水平上 PERV 的失活。团队对不同年龄(最大 100 天)的 PERV 灭活猪进行了基因分型,所有接受检查的猪均表现出约 100% 的 PERV 灭活率。
C 部分展示的是,在 mRNA 水平,所有猪均表现出约 100% 的 PERV 根除率。
正如杨璐菡团队所说:
「猪 1.0」不仅有利于提升对 PERV 的认识,也为猪到人的异种移植提供了更为安全的器官和组织来源。
猪 2.0 解决第二大难题
2018 年 10 月的一次研讨会上,杨璐菡团队的「猪 2.0」重磅公布,此次该团队解决了第二项难题——器官移植免疫排斥问题。
杨璐菡团队利用 CRISPR,首先敲除了部分免疫反应的基因,再插入抗免疫反应基因,并对部分调节凝血反应的基因进行编辑,从而解决了免疫排除问题。
当时,该团队表示希望将免疫反应进一步减小,最终实现免疫反应的完全消除。
猪 3.0 实现重大突破
解决了两大难题之后,「猪 3.0」也诞生了。
2020 年 9 月 21 日,杨璐菡团队题为 Extensive germline genome engineering in pigs(大规模的猪种系基因组工程)的研究成果发表于《自然》子刊《自然·生物医学工程》。

在这一论文正式发布之前(2019 年 12 月),该团队曾在预印本网站 bioRxiv 发布了未经同行审议的版本,提前展示了两只 5 天大的猪 3.0 的照片。

这一次,团队是将 CRISPR-Cas9 和转座子(transposon)技术结合,证明所有 PERV 失活小猪都可通过基因工程来消除 3 种异种抗原、表达 9 种人类转基因,从而增强猪器官和人类受体之间的免疫相容性、凝血相容性。
团队表示,他们所编辑的 13 个基因和 42 个等位基因在 猪 3.0 的生理、生育和种系遗传上均表现正常。通过体外试验,来自猪 3.0 的细胞对人类体液排斥反应、细胞介导的损伤和与凝血失调相关的发病机制具有抗性。

